SO3的杂化方式?
6 个回答
首先我要说明价键和杂化轨道理论是针对中心原子的孤立性研究,它简化了一部分次要的科学事实,可以方便的描述单个分子或簇的原子结合方式。up提出的这个问题如果是针对气态单个分子的,我们说这时SO3是以S为中心三个O占据平面正三角形的三个顶点,分子对称性是D3h,因此中心S是等性sp2杂化。如果是针对固体形态的SO3,比如说gamma相,以三聚体(SO3)3形式存在,那么此时S原子是不等性sp3杂化。
处理这种问题,我们是首先根据观察数据描述分子的对称性和形态,然后再根据价键和杂化轨道理论描述其中具体两个原子的电子结合方式。
三氧化硫熔沸点均较低,常温下为无色易挥发液体.其气态单分子的空间构型是平面正三角形,分子内所有4个原子均共面.中心硫原子采取sp2等性杂化方式:其中两个杂化轨道中各有单电子与两个氧原子的p轨道单电子成σ键,另一杂化轨道的孤电子对提供给第三个氧原子空p轨道成配位键;同时硫中垂直于该平面未杂化p轨道中的孤电子对与三个氧原子的平行p轨道电子(其中两个氧原子提供p轨道的单电子,第三个氧原子提供p轨道的孤电子对)组成离域π键,构型为4轨道6电子键.液态则以聚集态存在,固态时略有变化存在(SO3)3分子.
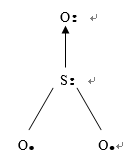
1明确Vsepr有局限性。杂化不能解释一切。
2按照非传统的理论,可以认为硫氧之间各一个单键且有一个派46(大π键)。
3按照共振论也可以认为硫与其中一个氧(哪个都行,三种互相共振)成双键与另两个成单键,这两个带负电,硫带两个正电 (共3个)
以及硫带三个正电,三个氧都带负电,成三个单键。
综上,四个共振式。
sp3杂化
Sp2
支持1楼的SP3杂化!化学老师也说SP3,这个问题纠结了我好久,谢谢你的答案!